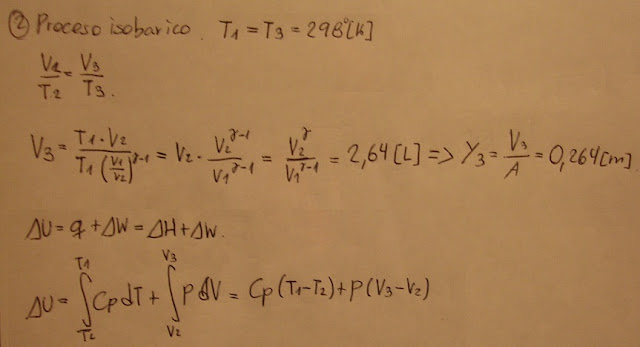Entropia
El universo entero se mueve por el hecho de que la energía fluye, y su dirección siempre es para favorecer la dispersión de esta, es decir, la energía se "desparrama" lo mas que puede hasta que llegara un punto en que el nivel energético sera igual en todos lados, esto es, el máximo nivel de entropia en donde no hay diferencia de energía en ningún punto. El universo abra alcanzado el estado absoluto de
equilibrio y seria la muerte termodinámica del universo.
Entonces, todos los fenómenos físicos y químicos que se dan en la naturaleza están cumpliendo que la energía va desde su nivel alto hacia el nivel bajo y de manera irreversible, que tan irreversible es? la entropia es la cantidad física inmedible directamente de cuan irreversible es el cambio de estado que afecta un sistema, dado como un diferencia de la cantidad de energía que absorbe o entrega el sistema y la cantidad de energía que el universo le entrega o absorbe del sistema.
Puesto así, analizaremos la dinámica de un caso en que un deposito sellado con un pistón sin roce contienen un gas ideal y la energía potencial gravitatoria hace trabajo sobre el pistón.
"pistón que cae por su propio peso"
Un pistón compuesto de una esfera maciza que aporta casi toda la masa total, ejerce una presión hacia abajo que junto con la presión interna del deposito que ejerce el gas compite contra la presión atmosférica. Inicialmente el sistema esta en equilibrio, el pistón esta siendo sujetado de forma que no cae, el volumen dentro del deposito no varia.
Luego repentinamente se deja caer el pistón libremente
Ocurre que el movimiento es violento y rápido por lo que se deduce que el cambio de estado del gas es un cambio adiabatico, en donde no intercambia energía con el entorno.
Luego, después de haber encontrado el equilibrio de fuerzas, el pistón esta en reposo pero por un periodo muy corto, pues como el gas se a expandido, su temperatura disminuye por lo que trata de buscar el equilibrio termodinámico, hay un intercambio de calor con el entorno que esta a temperatura ambiente. Mientra el calor fluye dentro del deposito sellado, la temperatura aumenta y proporcionalmente su volumen, pero la presión no debe variar ya que se encuentra en equilibrio con el peso y la presión atmosférica, así el gas solo se expande lentamente haciendo bajar el pistón aun más, hasta llegar al nuevo punto de equilibrio.
Alcanzado este punto es donde el pistón queda en reposo. Luego, se suelta la esfera maciza del piston dejándolo con una masa despreciable.
Análisis
 |
| esta relación entre la posición inicial y la posición de reposo (final) del pistón en el cambio de estado
|
Notamos que, en esta ecuación no permite que la fuerza que ejerce el peso sea de igual o mayor magnitud que la presion atmosférica por el área del pistón. Esto implicaría una indefinición en la formula ¿por que ocurre esto? porque el estado final en el problema se condiciona a que el gas tenga una menos presión a la inicial, de lo contrario implicaría que el gas se estuviera comprimiendo y eso es, que el pisto avance hacia arriba de forma inversa. Adema si las fuerzas son iguales, quiere decir que la presión del gas es cero que claramente es imposible.
Corolario: mientras mayor sea la masa del pistón, mayor sera distancia que este avance hasta encontrar el equilibrio. Si la presion atmosférica es mucho mayor a el peso del pistón dividido el área , el pistón no se mueve, esto se comprueba aumentando el área.
Para darnos una idea de lo que ocurre, consideremos condiciones ambientales a nivel de mar para hacer los cálculos, el estado inicial es entonces
Aire: gas diatomico, 1[mol]
P1 = 1[atm]
T1 = 298°[K]
Área del pistón = A = 100[cm^2] = 0,01[m^2]
Masa del pistón: 63,4[kg]
Posición inicial = Y1 = 10[cm] = 0,1[m]
El deposito es cilíndrico y lo suficientemente largo como para que el pistón baje sin salir de este.
 |
| Gráfico Presión Vs Volumen |
El trabajo realizado es hecho por la energía potencial gravitatoria
sobre el Gas, es decir un agente externo, esta aumentando la energía interna del Gas solo con trabajo
De un punto de vista termodinámico, el pistón esta bajando su nivel de energía transformándola en trabajo sobre el gas, se puede considerar que es una transferencia de energía mecánica, pero no fluye calor, por la naturaleza adiabatica del proceso, la entropia
del sistema se conserva, es decir, no hay trabajo degradado.
Luego, existe transferencia de calor con el entorno provocando una expansión isobárica del gas.
El sistema busca el equilibrio termodinámico aumentando su temperatura y su volumen
Y3 - Y1 = 0,264[m] - 0,1[m] = 0,164[m]
El pistón baja 16,4[cm] para alcanzar el equilibrio termodinámico y mecánico
El sistema aumenta significativamente su energía interna y por lo tanto su Entropia, donde sus moléculas están mas separadas y desordenadas.
El universo a perdido entropia, pero el cambio total de entropia es siempre positivo, siempre la energía se disipa lo mas que puede.
Por ultimo, se procede por desacoplar el pistón de su masa, por lo que este sube rápidamente para igualar la presión interior con la exterior, por lo que su presión aumenta mientras que su volumen disminuye, pero el aumento de presión es muy grande, debe ser compensado ademas por un aumento en la temperatura para lograr el nuevo equilibrio termodinámico, por lo que hace una contracción adiabatica, en donde una vez mas no se intercambia calor con el entorno
La entropia se conserva por que no hay trabajo degradado,
El gas queda a una temperatura superior a la ambiental, por lo que se enfriara y el volumen disminuirá isobaricamente quedando asi, en su estado inicial.
 |
| Gráfico Presión Vs Volumen |
Observaciones
Se comprueba que la entropia siempre va en aumento y es posible medirla, también cabe destaca que el proceso realizado es un proceso en donde se convierte trabajo en calor, algo así como lo inverso de una maquina de calor, de hecho este mismo proceso lo podemos reproducir fácilmente usando una jeringa de 5[ml]. El gas siempre compite con las presiones que lo rodean, trata de minimizar su presión y maximizar su volumen, sigue el mismo principio de la energia, el gas siempre trata de maximizar su entropia interna y minimizar su energia interna.